Плазма свiжозаморожена лейкофільтрована
Назва: “Плазма свiжозаморожена лейкофільтрована“
Основні властивості – плазма, отримана методом лейкофільтрації та заморожена для оптимального зберігання факторів згортання крові, здатна адекватно підтримувати лабільні фактори згортання крові у функціональному стані. Лейкофільтрація зменшує ризик переносу інфекцій, які не перевірялися за допомогою тестів або не були розпізнані.
Склад: об’єм (200±30) мл. Вміст фактору VIIIс після заморожування і розморожування у середньому 70% від дози плазми, загального білку – не менше 50г/л, еритроцитів менше 6,0х 109, лейкоцитів – менше 0,1х106, тромбоцитів менше 50,0х 109.
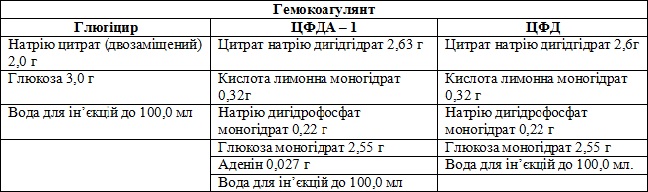
Лікарська форма: розчин
Показання до застосування: гостра масивна крововтрата (більше 30 % ОЦК) з розвитком геморагічного шоку й ДВЗ-синдрому. Розлади згортання крові, особливо у клінічних ситуаціях з множинним дефіцитом факторів згортання при відсутності відповідного вірусінактивного специфічного фактору згортання, лікування тромбоцитопенічної пурпури. При її застосуванні зменшується ризик виникнення негемолітичних фібрильних реакцій, НLА-аллоімунізації, респіраторного дистрес-синдрому, імуносупресій, передача інфекцій. Плазма свіжозаморожена лейкофільтрована рекомендована для лікування дітей та пацієнтів акушерсько-гінекологічного профілю.
Спосіб застосування: компонент вводять внутрішньовенно крапельно зі швидкістю, що не перевищує 40-60 крапель на хвилину. Дозу встановлюють індивідуально. Разова доза залежить від стану пацієнта, може обмежуватись однією дозою, а при необхідності 2-3 дозами. Дозу визначають із розрахунку не менше 15 мл/кг тіла до зупинки кровотечі і, як мінімум, 1 дози на кожні 4-6 доз еритроцитовмістних компонентів для попередження порушень коагуляції. У похилому віці слід уникати надмірної кількості використання компоненту і швидкого його введення, оскільки це може привести до перевантаження серцево-судинної системи.
Побічна дія:
– цитратна інтоксикація за умови швидкого переливання великих об’ємів;
– негемолітичні реакції на переливання (в основному лихоманка і кропивниця);
– передача вірусних агентів (ВІЛ 1/2 , гепатитів), сифілісу, навіть за умови ретельного відбору донорів і використання процедур скринінгу (серонеганивний період) та інших патогенів, наявність яких не перевірялась, менш виражена в порівнянні з трансфузією свіжозамороженої плазми;
– сепсис через ненавмисне бактеріальне забруднення;
– пов’язане з переливанням гостре ушкодження легень.
Застереження при використання: Плазму свіжозаморожену лейкофільтровану не варто використовувати тільки для усунення дефіциту об’єму при відсутності дефіциту згортання, або як джерело імуноглобуліну та інших білків крові, при наявності відповідного концентрату специфічного фактору згортання, який пройшов вірусінактивацію, при підвищеній індивідуальній чутливості до білків плазми у пацієнтів.
Протипоказання:
Абсолютних протипоказань для переливання компоненту немає.
Відносні протипоказання:
‑ корекція гіпоальбумінемії, гіпопротеїнемії та гіпогамаглобулінемії яка досягається використанням відповідно альбуміну, розчину амінокислот, концентратів імуноглобулінів;
‑ лікування гемофілії, хвороби Віллібранда та інших ізольованих уроджених дефіцитів коагулянтів і прокоагулянтів, при можливісті використовувати вірус-інактивовані або рекомбінантні препарати;
– ризик збільшення внутрішньосудинного об’єму, при наявності переваг використання кристалоїдів, синтетичних колоїдів і альбуміну.
Особливості застосування:
Застосовувати лише в умовах стаціонару бажано в першій половині дня, після легкого сніданку або натощак. Перед використанням плазма повинна пройти розморожування в контрольованих умовах і використана відразу після розморожування на протязі 1 години. Повторне заморожування плазми недопустиме.
Під час переливання свіжозамороженої плазми лейкофільтрованої забороняється використовувати трансфузію з одного контейнера декільком реципієнтам. Не підлягає застосування компонент з порушенням герметичності, маркування, при закінченні терміну придатності, при неправильному зберіганні , а також при зміну індивідуальних властивостій (кольору та інше).
Перед трансфузією лікар повинен переконатися в ідентичності позначеної групи крові донора і реципієнта, а у дітей і резус–належності, провести візуальний контроль гемосередовища. Після розморожування не повинно бути згустків нерозчиненого кріопреципітату. Під час переливання компоненту лікар, який виконує трансфузію для запобігання негативних реакцій, зобов’язаний провести біологічну пробу.
Компонент необхідно вводити за допомогою пристрою для переливання крові (ПК 22-02) з діаметром пор фільтра 170-120мкм, з дотримання правил асептики. Під час переливання необхідно проводити нагляд за реципієнтом. Швидке переливання холодного компоненту може виявитися небезпечним.
Взаємодія з іншими препаратами:
При розладах мікроциркуляції, без явищ дисимінованого внутрішньосудинного зсідання крові (ДВЗ) плазму свіжозаморожену лейкофільтровану переливають разом з реологічно активними препаратами (реополіглюкін тощо).
Умови зберігання і термін придатності:
Зберігати при температурі від мінус 30°С до мінус 40°С – 12 місяців, мінус 40°С і нижче – 24 місяці. Температурний режим зберігання плазми свіжомороженої лейкофільтрованої передбачає проведення цілодобового моніторингу.
Транспортування:
Для гарантованого збереження повноцінності СЗП система транспортування має забезпечити температуру не вище мінус 15° С в кінці терміну транспортування. Транспортні засоби без рефрижератора повинні бути обладнані термоізолюючим контейнером з акумулятором холоду, охолодженим до температури нижче мінус 30° С.
Лікувальний заклад при отриманні компоненту повинен впевнитись, що СЗП залишалась в замороженому стані на протязі всього періоду транспортування. При відсутності термінового переливання СЗП, її необхідно відразу помістити на зберігання при рекомендованих температурних умовах.
Пакування: в полімерних контейнерах (200±30) мл.
Виробник:
Комунальний заклад охорони здоров’я Харківський обласний центр служби крові, Україна.
Адреса: 61051, м. Харків, вул. Клочківська, 366, тел. (057) 337-85-01, факс: 337-83-38, e-mail: medhospk@list.ru
Експедиція КЗОЗ ХОЦСК працює цілодобово: тел. 057(337-33-96), 057(337-84-95)
Нормативні посилання:
1. Наказ МОЗ України від 09.03.2010 №211 «Порядок контролю за дотриманням показників безпеки та якості донорської крові та її компонентів».
2. Наказ МОЗ України від 02.06.05 № 247 «Про затвердження документів з питань контролю якості препаратів крові».
3. Наказ МОЗ України № 164 від 05.07.99 р.: «Інструкція з фракціонування донорської крові на її компоненти (плазма, еритроцити, тромбоцити, лейкоцити) та їх консервування», «Переливання компонентів та препаратів крові» (інструкція), «Контроль стерильності консервованої крові її компонентів , препаратів та умов їх заготівлі» (інструкція).
4. Наказ МОЗ України № 385 від 01.08.05р. «Про інфекційну безпеку донорської крові та її компонентів».
